Todas las pilas y baterías de consumo que se comercializan (ya sean primarias, no recargables, o secundarias, recargables) aparecen dos pequeños signos más (+) y menos (-) representados en n la etiqueta exterior. ‘Marcan’ el inicio y el fin del flujo de energía y constituyen la clave física y química fundamental de su funcionamiento.
En esencia, una batería funciona convirtiendo la energía química almacenada en energía eléctrica. El proceso necesita inevitablemente dos componentes, que son clave dentro de la batería, llamados electrodos: el cátodo, que forma el lado positivo (+), y el ánodo, que forma el lado negativo (-).

¿ Por qué dos polos y por qué enfrentados?
El fundamento técnico de los electrodos es que están hechos de dos materiales diferentes. El principio químico al que responden está basado lo expuesto en 1800 por Alessandro Volta, que descubrió que la combinación de diferentes metales podía generar una corriente eléctrica. Descubrió que esto ocurre porque cada tipo de metal tiene una "afinidad" química, o capacidad diferente para atraer electrones.
Estos electrodos están sumergidos en una sustancia química llamada electrolito. Para evitar un cortocircuito (que acabaría con la integridad física de la batería), se coloca un separador físico que impide que el cátodo y el ánodo entren en contacto. El electrolito reacciona entonces con los electrodos, provocando que los electrones con carga negativa se acumulen en el ánodo. Esta acumulación crea el terminal negativo, mientras que el cátodo desarrolla una carga positiva debido a la falta de electrones.
Este potencial de energía simplemente permanece ahí, esperando. Las reacciones químicas no se activarán por completo hasta que se conecte la batería a un dispositivo y se cree un circuito completo. Pero una vez que esto ocurre, la batería empieza a actuar inmediatamente como una ‘bomba’. Los electrones sobrantes del terminal negativo salen rápidamente, viajan por el dispositivo y son atraídos al terminal positivo.
El proceso continúa hasta que se agotan las sustancias químicas del electrolito y la batería se agota. Es decir, es imposible que una batería funcione sin polos positivo y negativo.
Ese flujo dirigido de negativo a positivo es la regla de oro de la energía de las pilas y las baterías sea cual sea su química o su tecnología. Y dado que la dirección del flujo es importante, no sorprende que la orientación física que se ve exteriormente sea importante.
Para muchos, la imagen clásica de una pila es la de un cilindro con terminales en cada extremo. Esto se aplica a la mayoría de las pilas de consumo (por ejemplo, las clásicas pilas AA), donde los terminales positivo y negativo se encuentran en extremos opuestos. Este diseño no solo es funcional, sino que también facilita la visualización de los puntos de inicio y fin del recorrido eléctrico.
Sin embargo, no todas las baterías están diseñadas con terminales en extremos opuestos. Sin ir más lejos, las clásicas baterías de 12 voltios de los coches en las que los terminales positivo y negativo están uno al lado del otro. En estos casos, la orientación física en un compartimento no es el problema. En cambio, la conexión se realiza mediante cables o contactos específicos. Los terminales suelen ser especialmente visibles para evitar confusiones peligrosas, como descargas eléctricas en las baterías del coche.
La ubicación de estos terminales cobra importancia en dispositivos que requieren varias celdas como es el caso de las grandes baterías de tracción de los coches eléctricos o híbridos que requieren colocar las celdas alternadamente, de modo que el extremo positivo de una celda se conecte al extremo negativo de la siguiente. Esta conexión en serie es una forma sencilla y eficaz de aumentar el voltaje total.
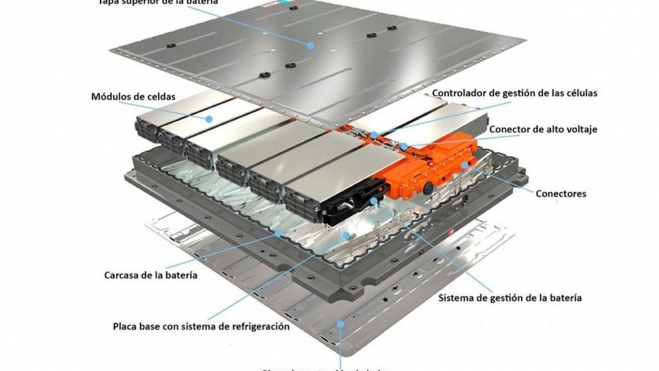
Así es la arquitectura de la batería de un coche eléctrico
La batería de un vehículo eléctrico se articula a partir de miles de celdas individuales, cuyo diseño puede variar entre formatos cilíndricos, prismáticos o tipo bolsa. Cada celda consta de un ánodo y un cátodo, separados por una fina lámina de polietileno o polipropileno que impide el contacto eléctrico directo y permite el paso de iones de litio disueltos en un electrolito orgánico.
Estas capas se enrollan o apilan según el formato elegido y quedan selladas en una carcasa metálica o polimérica, donde un sistema de válvulas controla la presión interna y evita fugas. Además, cada celda incorpora un circuito de protección que mide temperatura y voltaje, y corta la corriente en caso de sobrecarga, sobrecalentamiento o cortocircuito, garantizando la integridad y durabilidad de la unidad básica de almacenamiento.
En cada batería se agrupan decenas o cientos de estas celdas en módulos estancos, unidos mediante conductores de cobre o aluminio que establecen configuraciones en serie para alcanzar el voltaje requerido y en paralelo para aumentar la capacidad total.
Cada módulo integra un subsistema de refrigeración, con placas o canales por los que circula líquido refrigerante, y una unidad de control electrónico (BMS) que supervisa el estado de carga (SoC) y de salud (SoH) de todas sus celdas.
A su vez, varios módulos se ensamblan en el pack final, que incorpora un chasis rígido, conexiones de alta tensión hacia el inversor y protecciones mecánicas y térmicas. Gracias a esta arquitectura escalable, los fabricantes pueden adaptar la densidad energética, la potencia de salida y los sistemas de seguridad según el modelo de vehículo, optimizando peso, espacio y coste.



